Retour au format normal
Complications neuro-musculaires et ostéo-articulaires de l’IRC
Première publication : janvier 1999
Mise en ligne : 5 octobre 2000par
2. Anomalies neuro-musculaires :
Les anomalies neuro-musculaires observées chez les patients en insuffisance rénale avancée sont parmi les manifestations cliniques les plus précoces découvertes au cours de l’urémie.
Les symptômes initiaux sont modestes et comprennent une labilité émotionnelle, une insomnie et un manque de concentration idéatoire. Si l’état urémique progresse, des anomalies plus marquées sont observées avec une hyperreflectivité tendineuse, des clonies, un asterixis et une altération de la conscience qui évolue vers le coma, les convulsions et le décès.
La neuropathie urémique est une autre complication invalidante de l’IRC. La manifestation la plus précoce est le "syndrome des jambes sans repos" (le patient a tendance à éviter linactivité des membres inférieurs en raison d’une sensation d’engourdissement). Ce syndrome est suivi par une neuropathie sensorielle caractérisée par des paresthésies et une hyperalgie spécialement au niveau des pieds. Dans les cas les plus sévères, peut survenir une neuropathie motrice, symétrique et prédominant au niveau distal et pouvant manifester initialement par un steppage bilatéral. Histologiquement, les lésions des nerfs périphériques surviennent dans la portion distale des fibres médullées et comportent une perte de myéline (neuropathie démyélinisante). Pour des raisons inconnues, la neuropathie motrice est beaucoup plus fréquente chez l’homme que chez la femme.
3. Ostéodystrophie rénale
Une autre cause majeure d’impotence au cours de l’IRC et spécialement chez l’enfant est liée aux anomalies ostéoarticulaires regroupées sous le terme global dostéodystrophie rénale.
Chez l’enfant avec une IRC la croissance est nettement retardée. Ce retard de croissance peut être amélioré par la dialyse et un régime riche en protides et en calories mais même de cette façon, les enfants grandissent rarement normalement en dialyse. L’usage de glucocorticoïdes après transplantation est également associé à un retard de croissance. L’hormone de croissance permet de ratrapper ce retard de croissance chez l’enfant urémique et chez l’enfant transplanté rénal.
Un rachitisme avec déformation et impotence peut se développer chez l’enfant avec une insuffisance rénale avancée. Les anomalies radiographiques typiques du rachitisme sont des lignes irrégulières et fragmentées séparant la métaphyse du cartilage de croissance. L’espace séparant la ligne métaphysaire et le noyau épiphysaire est élargi et le centre épiphysaire apparaît de façon retardée. Un traitement par vitamine D et calcium peut être efficace pour corriger ces anomalies.
Cependant, chez l’enfant et chez l’adulte ayant une IRC avancée, les manifestations squelettiques les plus fréquentes sont liées à l’hyperparathyroïdie secondaire qui est caractérisée par une augmentation de la résorption osseuse ostéoclastique. L’histomorphométrie osseuse retrouve ce type de lésion chez plus de 80 % des patients urémiques. Les glandes parathyroïdiennes sont fortement hyperplasiques et la concentration circulante d’hormone parathyroïdienne (iPTH) est augmentée en raison de lhypocalcémie, de lhypocalcitriolémie et de lhyperphosphatémie. Cliniquement, il y a peu de symptômes et le diagnostic est établi devant des lésions osseuses caractéristiques de résorption sous-périostée des phalanges et l’aspect "poivre et sel" du crâne sur des radiographies de profil.
Certains patients développent parfois des tumeurs ostéoclastiques importantes ("tumeurs brunes" kystiques) dans les zones porteuses du squelette. La parathyroïdectomie est indiquée, permettant habituellement la guérison de ces lésions kystiques. L’hyperparathyroïdie se corrige habituellement après transplantation rénale. Dans certains cas cependant, il persiste une hypercalcémie menaçant la fonction du greffon et qui peut nécessiter une parathyroïdectomie.
Chez le sujet adulte insuffisant rénal chronique, l’ostéomalacie est devenue relativement rare et résulte essentiellement d’une intoxication aluminique plus que de l’urémie elle-même. L’ostéomalacie urémique aluminique est caractérisée par des douleurs osseuses fracturaires et une myopathie proximale. Cette forme d’atteinte osseuse est habituellement peu sensible aux analogues de la vitamine D.
Récemment, un troisième type d’atteinte osseuse a été rapporté, l’os adynamique. La définition est histologique avec l’absence de formation osseuse et de résorption. Il n’y a habituellement pas de traduction clinique, la PTH est normale ou basse (hypoparathyroïdie fonctionnelle) et en raison de l’absence de complication de cette situation, aucun traitement n’est habituellement nécessaire.
Les patients avec une IRC avancée ont typiquement une hypocalcémie modérée, une hyperphosphatémie variable (qui dépend de l’apport alimentaire), une hypocalcitriolémie modérée et des signes histologiques et biologiques d’hyperparathyroïdie. La prévention de l’hyperphosphatémie peut être obtenue par l’administration de chélateur du phosphore qui se lie au phosphate alimentaire dans l’intestin et en empêche l’absorption. Les sels d’aluminium ne sont plus utilisés en raison du risque d’intoxication aluminique et les principaux chélateurs du phosphore utilisés sont actuellement le carbonate ou l’acétate de calcium. Pour augmenter l’efficacité et la chélation du phosphate et en même temps diminuer le risque de survenue d’une hypercalcémie, ces médicaments doivent être administrés au milieu des principaux repas. La plupart des patients n’ont pas besoin de traitement par calcitriol. Le traitement par calcitriol nest indiqué à faible dose que chez les patients ayant une hyperparathyroïdie sévère et progressive. Cette situation se voit essentiellement au cours des néphropathies interstitielles chroniques de très longue durée d’évolution et souvent associées à une dysfonction tubulaire (néphronoptise par exemple).
4. Calcifications métastatiques
Une complication sévère de l’insuffisance rénale chronique est représentée par les calcifications métastatiques. Trois types distincts de dépôts métastatiques de phosphates de calcium sont décrits chez les patients urémiques. Les mécanismes spécifiques responsables de ces dépôts ne sont pas bien connus et il est possible que ces trois formes aient des mécanismes physiopathologiques différents.
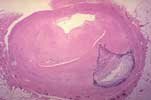
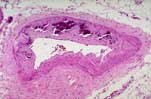
La forme la plus potentiellement grave de calcifications métastatiques est représentée par les calcifications vasculaires. Ces calcifications vasculaires peuvent affecter n’importe quelle artère de moyen calibre de l’organisme et peuvent parfois causer une insuffisance vasculaire ischémique avec une gangrène des extrémités, des ulcérations ischémiques de la peau mais aussi du tractus gastro-intestinal. Ces calcifications vasculaires persistent généralement après parathyroïdectomie ou même après transplantation rénale. Des signes histologiques de calcifications vasculaires surviennent même chez les jeunes patients urémiques et après l’âge de 50 ans, des signes radiographiques de calcifications vasculaires sont présents chez pratiquement 100 % des patients urémiques.
La deuxième variété de dépôts de phosphates de calcium résulte de l’hyperphosphatémie. Ces dépôts peuvent être rapidement immobilisés en réduisant la concentration plasmatique des phosphates et donc le produit phospho-calcique par la dialyse, les chélateurs intestinaux du phosphore ou encore par la transplantation.
Ces dépôts peuvent se présenter sous plusieurs formes : calcifications conjonctivales avec rougeur et sensation d’irritation des yeux ; calcifications péri-articulaires limitant les mouvements articulaires en raison de la taille parfois importante de ces dépôts ; épisodes d’arthrite aiguë par dépôts de cristaux d’hydroxyapatite dans le liquide synovial (chondrocalcinose).
Le dernier type de calcifications observées chez les patients urémiques sont les calcifications viscérales qui surviennent au niveau du poumon, du muscle squelettique et du myocarde. Ces dépôts amorphes de phosphates de calcium ont une composition physico-chimique différente des deux autres formes de dépôts de phosphate de calcium. Les calcifications vasculaires et celles induites par l’hyperphosphatémie sont constituées d’hydroxyapatite (c’est-à-dire le calcium minéral similaire à celui de l’ostéogénèse) alors que les calcifications viscérales ont des propriétés physico-chimiques de whitlockite.
Les calcifications cardiaques surviennent initialement dans le tissu de conduction et peuvent être responsables d’arythmie sévère. Lorsque les calcifications cardiaques sont plus importantes, elles peuvent atteindre l’ensemble du myocarde et entraîner le décès par bas-débit cardiaque. Les calcifications pulmonaires induisent une réponse fibreuse des petites artérioles et des septa-alvéolaires. Il en résulte des anomalies de diffusion et restrictives aboutissant à l’hypoxémie. Le mécanisme physio-pathologique responsable du développement de ces dépôts viscéraux de phosphates de calcium n’est pas bien compris. On ne sait pas non plus si ces dépôts sont mobilisables par la réduction du produit phospho-calcique ou même la transplantation.
Le prurit généralisé est une complication extrêmement désagréable de l’insuffisance rénale chronique. Dans certains cas, le contenu élevé en calcium au niveau de la peau peut être en cause. La parathyroïdectomie améliore parfois le prurit mais chez la plupart des patients, la réduction du phosphate sanguin avec des chélateurs intestinaux ou l’intensification de la dialyse sont suffisants.
5. Amylose ß2m
La béta2-microglobuline est une protéine de petit poids moléculaire (PM 12 KD), dont la production est de 200 mg/jour, éliminée par filtration glomérulaire, puis catabolisme tubulaire proximal. La béta2-microglobuline s’accumule au cours de l’insuffisance rénale avec des concentrations plasmatiques qui peuvent atteindre 50 X les valeurs normales et se dépose dans les tissus sous la forme damylose. Lamylose béta2-microglobuline est responsable des manifestations articulaires, du syndrome du canal carpien, des lésions lytiques sous-condrales au niveau des points d’insertion des tendons, des disques inter-vertébraux et enfin des dépôts dans la moëlle osseuse. Cliniquement, les dépôts d’amylose béta2-microglobuline sont responsables du syndrome du canal carpien, de kystes osseux, d’une spondylarthropathie destructive en particulier au niveau cervical, d’arthrite et de périarthrite scapulo-humérale et enfin de camptodactylie. Lamylose ß2m est une complication plus fréquente chez les sujets âgés et nécessite généralement plusieurs années de dialyse avant de se manifester. Ces dépôts d’amylose béta2-microglobuline sont pas ou peu réversibles par la transplantation rénale.