Votre IP : 209.237.238.224
Article paru sur le site NephroHUS
http://nephrohus.org le 5 octobre 1999
Lithiase urinaire : Formes cliniques
Première publication : septembre 1999
Mise en ligne : 5 octobre 1999par
Généralités
La lithiase urinaire est définie comme un agrégat cristallin survenant dans le système collecteur de l’appareil urinaire (à la différence de la néphrocalcinose où ces agrégats cristallins surviennent dans le parenchyme rénal) et qui a atteint une taille suffisante pour aboutir à des manifestations cliniques ou être visibles par l’imagerie.
Epidémiologie
Dans les pays occidentaux, la lithiase urinaire est pratiquement toujours rénale. 0,1 à 0,4 % de la population développe une lithiase rénale chaque année et environ 8 à 15 % de la population des pays occidentaux développent une lithiase rénale à un moment donné de leur vie. La lithiase rénale tend à récidiver et le taux de récidive est d’environ 75 % à 20 ans.
La plupart du temps, la lithiase rénale est une maladie relativement bénigne sans grandes conséquences cliniques à long terme mais cependant responsable d’un nombre important d’arrêts de travail. Dans quelques pourcents des cas, la lithiase rénale est sévère et aboutit directement ou indirectement à la perte de la fonction rénale. Ce sont ces formes graves de lithiase qui nécessitent d’être identifiées, évaluées à la recherche d’une cause nécessitant un traitement spécifique.
Formes de la lithiase rénale
La lithiase oxalo-calcique représente 80 à 85 % des formes de lithiase. Ces lithiases sont parfois associées à du phosphate de calcium.
a) Lithiases calciques hypercalciuriques
Dans environ 50 % des cas, on retrouve une hypercalciurie favorisant la lithiase oxalo-calcique. L’hypercalciurie est définie par une excrétion urinaire de calcium supérieure à 0,1 mmol/kg de poids/jour dans les deux sexes (4 mg/kg).
En-dehors de quelques formes spécifiques peu fréquentes, le mécanisme de l’hypercalciurie n’est pas bien connu et celle-ci est donc dite "hypercalciurie idiopathique".
- L’hypercalciurie idiopathique tend à être familiale, elle est plus fréquente chez l’homme et le premier calcul survient souvent au cours de la troisième décennie.
voir la figure "Cristallurie d’oxalate de calcium au cours d’une hypercalciurie idiopathique. La cause de l’hypercalciurie idiopathique n’est pas bien définie mais elle s’associe à une augmentation de l’activité de l’ATPase calcium magnésium membranaire érythrocytaire et aucune mutation du gène codant pour cette pompe calcique n’a été jusqu’à maintenant retrouvée. Une augmentation du nombre des récepteurs à la vitamine D a été mise en évidence sur des lymphocytes chez quelques patients avec une hypercalciurie idiopathique. Il n’a pas été cependant retrouvé jusqu’à maintenant d’anomalie du gène codant pour la résistance à la vitamine D ou du gène codant pour l’alpha-hydroxylase.
L’ensemble des hypercalciuries idiopathiques ont un commun une augmentation de l’absorption nette du calcium intestinal, une augmentation du calcitriol (1,25 dihydroxycholécalciférol) et une augmentation relative de l’absorption du calcium pour les taux de calcitriol. La plupart ont également une diminution de la densité minérale osseuse, peut-être en rapport avec (ou médiée par) une augmentation de production d’interleukine.
La classification proposée en 1982 par C. Pack divisant les hypercalciuries idiopathiques en absortives, rénales et résorptives est pratiquement abandonnée :
- cette classification repose sur les tests complexes réalisés en situations extraphysiologiques,
- la classification n’est pas reproductible dans le temps chez un même individu (selon lalimentation et la saison),
- les anomalies biologiques observées sont pratiquement identiques et n’impliquent pas de spécificité thérapeutique.
- Deux formes génétiques monogéniques d’hypercalciurie normocalcémique ont été bien identifiées et sont responsables de lithiase calcique sévère et récidivante : la maladie de Dent est une forme rare de lithiase secondaire à une hypercalciurie associée à une hypophosphatémie, un rachitisme, une néphrocalcinose. Cette maladie correspond à une mutation dans le gène du transporteur Cl CN5 et est transmise selon un mode récessif lié à l’X.
- L’acidose tubulaire rénale distale se complique d’environ 2/3 des cas par une néphrocalcinose ou une lithiase rénale ou les deux. Les calculs sont généralement composés de phosphate de calcium. A l’inverse, les patients ayant une acidose tubulaire rénale proximale n’ont pas de néphrocalcinose ou de lithiase mais développent une ostéomalacie ou un rachitisme.
Le mécanisme de la formation de lithiase chez ces patients est multifactoriel : augmentation de la calciurie et de la phosphaturie, pH urinaire élevé et diminution de l’excrétion de citrate. L’hypercalciurie est une conséquence directe de l’acidose qui diminue la réabsorption tubulaire de calcium. Il n’y a pas d’augmentation associée de l’absorption intestinale du calcium si bien que le calcium provient de l’os ce qui entraîne une déminéralisation progressive. L’augmentation du pH urinaire diminue la solubilité des complexes phosphocalciques. Le citrate est réabsorbé dans le tube proximal et cette réabsorption est augmentée par l’acidose. Le citrate physiologiquement se lie au calcium urinaire, abaisse sa concentration et agit comme un inhibiteur de la cristallisation.
Le traitement repose sur l’administration d’alcalins qui réduisent la néphrocalcinose et la lithiase urinaire en diminuant l’excrétion de calcium, en augmentant l’excrétion de citrate malgré la persistance d’un pH urinaire élevé.
b) Hypercalciurie-Hypercalcémie
Dans environ 2 à 5 % des cas de lithiase hypercalciurique, la calcémie est élevée parfois très modérément ce qui doit faire rechercher une cause hormonale :
- Hyperparathyroïdie primitive : L’élévation de la calcémie peut être très modérée juste à la limite supérieure de la normale et dans cette situation, le dosage du calcium ionisé peut être utile. Le calcul est composé habituellement d’oxalate de calcium et une fraction d’hydroxyapatite.
- Les granulomatoses, notamment la sarcoïdose et la tuberculose peuvent être responsables d’hypercalciurie hypercalcémie. Les tissus granulomateux sont capables de convertir le calcidiol (25 hydroxy-vitamine D3) en calcitriol (1,25 dihydroxycholécalciférol).
- On peut en rapprocher les lithiases hypercalciuriques secondaires à des supplémentations excessives en vitamine D, notamment associées à des apports calciques importants. Dans toutes ces situations, la concentration de parathormone circulante est abaissée.
Plus exceptionnellement, une maladie de Cushing, responsable d’un hypercortisolisme endogène, peut être responsable d’une hypercalciurie et de lithiase rénale. Cette forme s’associe habituellement à une déminéralisation osseuse.- Un grand nombre de cancers sont responsables d’une hypercalcémie-hypercalcliurie (médiée par le PTHrp) mais la survenue de lithiase ou de néphrocalcinose y est plus rare en raison de la très grande vitesse de l’évolution clinique.
c) Normocalciurie
Dans environ la moitié des cas, la lithiase calcique ne s’associe pas à une hypercalciurie franche.
- La diminution de l’excrétion urinaire de citrate (hypocitraturie) est un facteur favorisant la lithiase calcique. L’acidose et la rétention d’acide est la cause principale d’hypocitraturie qui touche 20 à 60 % des patients. L’hypocitraturie peut être la seule manifestation d’une acidose distale habituellement incomplète dans cette forme, révélée par la lithiase calcique. L’hypocitraturie correspond le plus souvent à un apport protidique alimentaire excessif, à une acidose métabolique résultant d’une diarrhée chronique (perte intestinale d’alcalins), une hypokaliémie (acidose intracellulaire), l’exercice physique (acidose lactique). Un diagnostic différentiel important est l’infection urinaire qui entraîne une hypocitraturie par la dégradation du citrate par les enzymes bactériens. Le dosage de la citraturie est inutile sur des urines infectées.
L’hypocitraturie doit être traitée par la réduction des apports protidiques alimentaires et si nécessaire une supplémentation en alcalins. Les sels alcalins de sodium doivent être évités dans la mesure du possible car ils ont tendance (à la différence des sels de potassium) à augmenter l’excrétion urinaire de calcium.
- L’augmentation de l’excrétion urinaire d’oxalates (hyperoxalurie) contribue à la formation de lithiase calcique (oxalo-calcique). L’hyperoxalurie peut être soit génétique, soit acquise.
L’hyperoxalurie primaire génétique est rare. L’hyperoxalurie de type 1 résulte de la mutation inactivatrice du gène codant pour l’alanine-glyoxylate-aminotransferase. L’hyperoxalurie de type 2 résulte d’une mutation inactivatrice du gène codant pour la glyoxalate réductase diglycérate-déshydrogénase et représente une forme cliniquement moins sévère. Dans 1/3 des cas, ces formes sont accessibles à un traitement par la pyridoxine qui permet de normaliser l’excrétion urinaire d’oxalate.
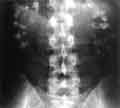
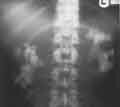
voir la figure "Radiographie sans préparation au cours d’une oxalose primitive : aspect caractéristique de calcification en masse des deux reins
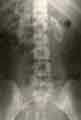
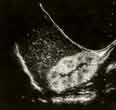
voir la figure "Aspect échographique : oxalose primitive typique.
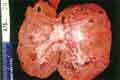
voir la figure "Oxalose primitive : aspect macroscopique révélant la néphrocalcinose et des petits kystes corticaux disséminés.
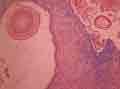
voir la figure "Cristaux d’oxalate de calcium dans la lumière tubulaire au cours d’une oxalose primitive (microscopie à polarisation x 350)
Une hyperoxalurie acquise est retrouvée chez environ 10 % des patients et résulte soit d’une augmentation de l’absorption intestinale d’oxalate (hyperoxalurie entérique) soit de la production endogène augmentée. L’oxalate est un produit terminal du métabolisme. Chez l’homme sain, moins de 5 % de l’oxalate alimentaire sont absorbés, cependant l’absorption d’aliments riches en oxalate, comme les épinards, le chocolat, les noix et le cacao peut augmenter l’excrétion urinaire d’oxalate de 25 à 50 %. L’absorption intestinale d’oxalate se fait essentiellement dans le colon et elle est augmentée par une diminution du calcium luminal dans la mesure où l’oxalate forme avec le calcium des sels insolubles qui ne peuvent alors être absorbés. Des maladies intestinales, comme la maladie de Crohn, la malade coeliaque et les courts circuits iléaux avec colon fonctionnel qui aboutissent à une malabsorption des graisses alimentaires favorisent l’absorption d’oxalate dans l’intestin. La chélation des acides gras et biliaires par la choléstiramine et l’augmentation du calcium alimentaire diminue l’absorption d’oxalate et l’excrétion urinaire de celui-ci.
L’oxalate peut être produit par l’oxydation de l’acide ascorbique et l’oxydation du glycolate. La supplémentation alimentaire en acide ascorbique augmente l’excrétion urinaire d’oxalate chez certains patients.
Les hyperoxaluries endogènes s’accompagnent d’une augmentation de la production de glycolate et une hyperglycolaturie.
Une forme inhabituelle de dépôts aigus de cristaux oxalocalciques responsables soit de néphrocalcinose, soit de lithiase rénale, est secondaire à l’ingestion soit accidentelle, soit intentionnelle de l’antigel éthylène-glycol qui est métabolisé en oxalate.d) Dans un certain nombre de cas, aucune anomalie métabolique n’est retrouvée dans l’évaluation d’une lithiase calcique.
La plupart de ces formes correspondent soit à des anomalies métaboliques anciennes transitoires, soit à la cristallisation et la formation de calculs liée à un apport hydrique insuffisant, (le débit de calcium et d’oxalate urinaire sont normaux mais la concentrations est élevée au dessus du seuil lithogène) ou soit encore à des anomalies constitutionnelles des voies urinaires aboutissant à des défauts subtils de la composition urinaire (Maladie de Cacci-Ricci) avec hypercalciurie et tendance à l’acidose.
voir la figure "Maladie de Cacci-Ricci ou ectasie canaliculaire précalicielle : aspect macroscopique, la médullaire comporte de nombreux tubes collecteurs dilatés et kystiques.
voir la figure "Maladie de Cacci-Ricci : dilatations kystiques précalicicielles (médullaires) contenant des concrétions non-calciques (matrice potentielle de calculs)
voir la figure "Néphrocalcinose au cours d’une forme sévère de maladie de Cacci-Ricci"
Le pH urinaire est un déterminant majeur de la supersaturation en acide urique et la formation de calculs. Un pH urinaire acide de 5, même en cas de concentration normale en acide urique urinaire (inférieure à 800 mg/24 h ou /l) peut aboutir à une supersaturation et favoriser la lithogénèse. Le pH urinaire, c’est-à-dire la concentration en protons libres dans l’urine est déterminée par la quantité d’acide endogène nette produite et la proportion de cette acidité excrétée soit sous forme d’ammonium, soit sous forme d’acidité titrable. Lorsque l’acidité peut être éliminée sous forme d’ammoniurie (ammoniaque + proton), la concentration urinaire de proton libre diminue et le pH urinaire augmente. Les sujets développant une lithiase urique semblent excréter l’acidité urinaire davantage sous la forme dacidité titrable que sous la forme dammoniurie.
La quantité d’acide urique endogène et donc l’excrétion urinaire dépend essentiellement chez l’individu sain de la consommation alimentaire de purines à partir de la viande, de la volaille et du poisson. Certains patients atteints de goutte ont une hyperproduction modérée d’acide urique ; celle-ci étant par ailleurs fortement augmentée dans certains défauts génétiques rares du métabolisme des purines comme le syndrome de Lesch et Nyhan. Les patients avec un syndrome myéloprolifératif peuvent produire des quantités massives d’acide urique à l’occasion d’une chimiothérapie (syndrome de lyse tumorale). Les sujets ayant des diarrhées chroniques sont à risque de développer une lithiase uratique en raison de la déshydratation de l’acidose métabolique chronique induite par la perte de base dans la diarrhée et donc des urines acides. Le traitement par probénécid et par larges doses de salicylés favorise l’excrétion d’acide urique urinaire et prédispose également à la formation des calculs uriques.
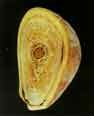
voir la figure "Calcul d’acide urique pur. La surface est homogène, microcristalline, de couleur beige-orangé.
voir la figure "Section d’un calcul d’acide urique : aspect arrondi, lisse et brun à l’extérieur ; structure laminée typique à l’intérieur.
voir la figure "Cristallurie d’acide urique"
La base du traitement de la lithiase urique repose sur l’hydratation, la modération des purines alimentaires, l’alcalinisation des urines et, si nécessaire, l’administration d’allopurinol (Zyloric®). L’alcalinisation particulièrement importante est assurée sous la forme soit de bicarbonate, soit de citrate et doit viser à obtenir un pH urinaire supérieur à 6 mais inférieur à 7 tout au long du jour et de la nuit. Si le pH urinaire diminue l’acétazolamide peut être utilisé mais avec le risque d’une acidose métabolique hypokaliémique systémique modérée. Un pH urinaire supérieur à 7 doit être évité car celui-ci favorise le risque de lithiase oxalo-calcique.
Dans certains cas des lithiases oxalocalciques peuvent être favorisées par une nucléation hétérogène liée à des quantités importantes d’acide urique urinaire. Dans ces cas, l’allopurinol semble pouvoir avoir un effet favorable sur la formation de lithiase oxalocalcique.
Ces lithiases se forment uniquempent lorsque l’urine est infectée par des bactéries possédant l’équipement enzymatique pour dégrader l’urée. La plupart des espèces de Protéus et de Providencia possèdent cette uréase de même que Klebsiella Pneumoniae, Serratia Marcesens, Ureoplasma Urealiticum et certains Hemophilus.
L’uréase bactérienne hydrolyse l’urée pour former de l’ammoniaque NH3, du gaz carbonique CO2, de l’eau et consomme un proton durant l’hydrolyse ce qui aboutit à une augmentation du pH urinaire. Dans cette urine alcaline, l’ammoniaque NH3 s’hydrolyse spontanément en hydroxyde d’ammonium et en bicarbonate. Le pH urinaire très alcalin favorise la dissociation des phosphates en phosphates trivalents favorisant la formation de struvite (phosphate ammoniaco-magnésien) et de carbonate apatite. Cette cascade d’évènements est totalement dépendante de la présence de l’uréase bactérienne.
Les lithiases de struvite peuvent survenir secondairement à d’autres calculs obstructifs et favorisant une infection. Les calculs de struvit peuvent augmenter rapidement de taille et remplir le système collecteur rénal aboutissant à la formation de calculs coraliformes. L’hématurie est fréquente de même que l’insuffisance rénale consécutive à l’obstruction et à l’infection.
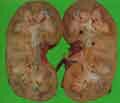
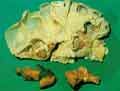
voir la figure "Macroscopie d’un rein : calculs coraliformes obstructifs
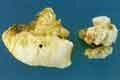
voir la figure "Volumineux calcul coraliforme moulant le bassinet. La surface est de couleur et de structure hétérogène avec des couches incomplètes témoignant d’une croissance rapide.
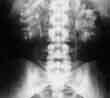
voir la figure "Radiographie sans préparation : volumineux calculs coraliformes bilatéraux. Ces formes s’accompagnent de lésions rénales interstitielles et d’insuffisance rénale.
Lablation chirurgicale des calculs est rarement efficace car tout fragment lithiasique résiduel contient des germes qui sont le nid d’une formation de nouveaux calculs. La néphrolithotomie percutanée peut être utilisée pour essayer d’éradiquer complètement les calculs de struvite.
Une antibiothérapie chronique peut diminuer la progression de la maladie mais est rarement curative. L’uréase bactérienne peut être inhibée par l’acide acétohydroxonamique qui ralentit la vitesse de formation des calculs. L’utilisation de ce produit est limitée par ses nombreux effets secondaires.
Globalement, le traitement des lithiases de struvite est difficile mais cependant important car ces formes de lithiases évoluent souvent vers la néphrectomie et/ou linsuffisance rénale.
La cystinurie est une maladie héréditaire rare définie par un défaut tubulaire du transport des aminoacides dibasiques aboutissant à laugmentation de l’excrétion urinaire de cystine, d’ornithine, de lysine et d’arginine. Les lithiases urinaires se forment habituellement au cours de la troisième ou quatrième décennie, mais une représentation retardée est parfois possible.
En raison du contenu en souffre de la molécule de cystine, les calculs volumineux, souvent coraliformes, bilatéraux sont visibles sur les radiogaphies d’abdomen sans préparation. Un petit calcul isolé cependant peut être faiblement visible et passer inaperçu.
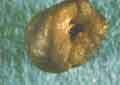
voir la figure "Lithiase cystinique : Les lithiases volumineuses sont habituellement radio-opaques en raison de la présence de l’atome soufre dans ces calculs.
voir la figure "Lithiase cystinique, faite de gros cristaux, non acérés, polygonaux, de couleur brun jaune-clair.
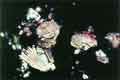
voir la figure "Cristallurie cystinique. La présence de tels cristaux hexagonaux dans l’urine est toujours pathologique.
La cystine est un acide aminé très peu soluble à 300 mg/l à pH neutre. La quantité normale de cystine éliminée dans l’urine, environ 30 à 50 mg/jour est facilement soluble dans un volume urinaire normal de 1 litre. Chez des patients cystinuriques homozygotes excrétant entre 250 et 1000 mg de cystine quotidiennement, la cystine insoluble précipite et favorise la formation de calculs. Les sujets cystinuriques hétérozygotes excrètent des quantités intermédiaires avec un risque lithogène plus faible.
Il existe au moins 3 types distincts de cystinurie, classifiés en fonction des anomalies de transport intestinal associées. Dans la cystinurie de type 1, des mutations du gène pour le transporteur des aminoacides dibasiques (SLC 3 A1) ont été découvertes. Les défauts moléculaires dans la cystinurie de type 2 et de type 3 ne sont pas pour l’instant déterminés.
Le traitement de la cystinurie vise à diminuer la concentration urinaire de cystine en-dessous des limites de la solubilité. Le précurseur de la cystine, la méthionine, est un acide aminé semi-essentiel et il est donc difficile de réduire son apport alimentaire. L’augmentation du volume urinaire à 3-4 litres par jour est l’approche initiale mais peu pratique et souvent insuffisante. L’augmentation du pH urinaire au-delà de 7,5 augmente la solubilité de la cystine mais cet objectif est souvent difficile à obtenir, surtout à maintenir sur une période de temps prolongée. La thiopronine (Acadione®) ou la D-pénicillamine (Trolovol®) se lient à la cystine et réduisent la supersaturation urinaire en formant un disulfide mixte soluble avec la cystine. Ces médicaments présentent de nombreux effets secondaires liés à leur groupement sulfhydrile (SH) qui en limite l’usage et les font réserver aux lithiases compliquées et toujours en complément des traitements précités. L’intérêt du captopril (Lopril®) aux doses actuellement utilisées (< 150 mg/j) reste encore très controversé.
P.S.
LECTURES RECOMMANDÉES
Pak CY. Kidney stones. Lancet 1998 ;351:1797
Bushinsky DA. Nephrolithiasis. JASN 1998 ; 917