|
|||||||||||
|
Glomérulonéphrites : Glomérulonéphrite extramembraneuse
mercredi 6 octobre 1999
|
|
DANS LA MÊME RUBRIQUE :
MOTS CLÉS ASSOCIÉS À L'ARTICLE :
ARTICLES DANS LE MÊME THEME :
|
La glomérulonéphrite extramembraneuse est la cause la plus fréquente de syndrome néphrotique primitif de ladulte, représentant environ 20 % des cas. Cest une affection relativement rare chez lenfant.
L’incidence de la thrombose des veines rénales varie de 5 à 50 % selon les études, dépendant essentiellement de l’acharnement avec laquelle on recherche cette complication. La thrombose de la veine rénale doit être évoquée en particulier devant l’existence d’une douleur lombaire, d’une hématurie macroscopique, d’une élévation des LDH (infarctus rénal) devant une aggravation aiguë de la fonction rénale ou une augmentation brutale de la protéinurie. Le dépistage peut être réalisé par l’échographie doppler des veines rénales ou la RMN mais le diagnostic définitif repose sur l’angiographie des veines rénales. Sur la biopsie rénale, un infiltrat glomérulaire avec des polynucléaires marginés et un oedème interstitiel peuvent suggérer la présence d’une thrombose de la veine rénale upsilatérale. Dans la plupart des cas cependant, la thrombose de la veine rénale est asymptomatique et peut se compliquer ou être révélée seulement par une thrombo-embolie pulmonaire. La GEM est divisée artificiellement en 3 types :
Dans les formes avancées ou très protéinuriques, une fibrose interstitielle ou une atrophie tubulaire peuvent être observées et ont une signification pronostique péjorative. Il n’y a pas de corrélation stricte entre les stades, les types histologiques et le degré de protéinurie. Un stade 3 est cependant souvent associé à une réduction de la filtration glomérulaire.
L’étiologie et la physiopathologie de la GEM sont inconnues mais les études expérimentales suggèrent que les dépôts immuns sous épithéliaux sont liés à une interaction d’un auto-anticorps circulant sur un antigène présent à la surface des cellules épithéliales glomérulaires. Les complexes immuns sont formés in situ et grossissent pour former des dépôts électrondenses dans l’espace sous-épithélial. L’altération de la perméabilité glomérulaire semble secondaire à l’activation locale du complément, notamment les fractions terminales C5b-9 ou MAC (complexe d’attaque membranaire) et à la génération de radicaux oxygénés toxiques. L’augmentation de l’excrétion urinaire de C5b-9, de C3dg, un produit de dégradation du C3 et/ou les dépôts glomérulaires de C3 pourrait signifier la formation active de complexes immuns in situ. La nature précise de l’antigène dans la maladie humaine n’est pas connue. Dans certains cas, les antigènes non rénaux plantés sont en cause, comme c’est le cas de l’antigène HBe dans le GEM secondaire à l’hépatite B, du DNA double brin dans la GEM lupique, de l’antigène carcino-embryonnaire (ACE) dans les GEM associées au cancer du colon, la thyroglobuline dans les GEM associées aux thyroïdites et l’insuline de porc dans les GEM associées au diabète.
Une néoplasie sous-jacente est responsable de 5 à 10 % des GEM de l’adulte, le risque étant le plus important chez les patients de plus de 60 ans. Il s’agit le plus souvent d’un cancer solide (adénocarcinome du colon ou du poumon). La GEM et la protéinurie s’amendent habituellement avec l’ablation de la tumeur.
Environ 10 à 20 % des cas néphropathies lupiques se présentent histologiquement par une GEM. Chez certains des patients l’atteinte rénale est au premier plan et il ny a pas initialement de symptôme ou d’anomalie sérologique évocatrice de lupus. Dans cette situation, certains éléments histologiques orientent vers l’origine lupique sous-jacente, en particulier sur l’immunofluorescence, la présence de dépôts abondants d’IgG mais aussi d’IgA et de C1q, une prolifération mésangiale modérée associée, éventuellement à des dépôts mésangiaux d’immunoglobulines et en microscopie électronique, la présence à la fois de dépôts immuns sous-endothéliaux et extramembraneux ainsi que la présence de structures tubulo-réticulées dans les cellules endothéliales glomérulaires (structures induites par l’interféron alpha).
Chez des patients ayant une arthrite rhumatoïde, l’incidence de la GEM est de 5 à 7 % chez les patients traités par pénicillamine et 1 à 3 % chez ceux traités par des sels d’or parentéraux. La protéinurie se manifeste habituellement dans les 6 à 12 mois suivant le début du traitement mais elle est parfois plus retardée. L’arrêt des médicaments entraîne la disparition de la protéinurie dans pratiquement tous les cas mais la résolution est lente avec une moyenne de 9 à 12 mois après l’arrêt. D’autres médicaments peuvent induire des GEM, comme la thiopronine et le captopril à fortes doses ; ces deux médicaments ayant comme la pénicillamine, un groupe sulfhydrile. Les anti-inflammatoires non stéroïdiens sont également responsables en particulier le diclofénac (Voltarene®).
La GEM liée à l’hépatite B survient le plus souvent chez des enfants dans des zones endémiques, la plupart du temps porteurs asymptomatiques sans histoire d’hépatite aiguë ou active. Les transaminases sont souvent normales ou légèrement augmentées et la sérologie est positive pour les antigènes de surface, les anticorps anti-HBc et habituellement l’antigène HBe. L’antigène e et l’anticorps cationique anti-HBe semblent être les principaux responsables des dépôts immuns glomérulaires. Les GEM liées à l’hépatite B peuvent être associées à une hypocomplémentémie. La résolution spontanée de la protéinurie est habituelle chez les enfants mais pas chez les adultes dont la plupart ont une maladie progressive. Le traitement par glucocorticoïde est contre-indiqué car ces agents peuvent augmenter la réplication virale et favoriser l’hépatite chronique active. Inversement, le traitement antiviral pourrait être bénéfique sur l’atteinte rénale.
Plusieurs autres causes de GEM sont représentées par la syphilis congénitale et secondaire, le rejet chronique d’allogreffe, l’infection par le virus de l’hépatite C, la sarcoïdose, le syndrome de Sjogren, l’exposition chronique au formaldéhyde, le paludisme et la schistozomiase hépatosplénique dans les régions d’endémie. Globalement, les éléments suivants peuvent être considérés :
Ces chiffres doivent être modulés par la connaissance d’un certain nombre de facteurs de risque permettant d’affiner l’évaluation du risque d’insuffisance rénale.
Les glucocorticoïdes seuls n’exercent aucun bénéfice sur la rémission du syndrome néphrotique ou la prévention de l’insuffisance rénale progressive et ne doivent donc pas être utilisés. Il n’y a de même pas de place pour le traitement par azathioprine dans le traitement de la GEM. Inversement le bénéfice d’un traitement cytotoxique alkylant (cyclophosphamide ou chlorambucil) semble relativement bien établi du moins sur la rémission du syndrome néphrotique . Dans la mesure où la plupart des essais contrôlés ont utilisé une association d’agent alkylant et de glucocorticoïde, il est recommandé que ces deux agents soient associés bien qu’il n’y ait pas de preuve formelle concernant le rôle complémentaire des glucocorticoïdes associés. Globalement le risque relatif d’obtenir une rémission complète chez les patients traités par alkylant est de 3,4 à 4,8. Dans ces analyses, le bénéfice en terme de survie rénale est moins évident, bien que la rémission soit un facteur important déterminant de non progression vers l’insuffisance rénale terminale. Une méta-analyse des essais contrôlés randomisés ne donne pas de préférence pour le chlorambucil ou le cyclophosphamide. Ces traitements doivent être considérés comme équivalent en terme d’efficacité. Ces deux formes d’agents cytotoxiques sont associés à une toxicité significative à court et long terme. Le risque de survenue de cancers vésicaux de nombreuses années après l’initiation d’un traitement par cyclophosphamide suggère que le chlorambucil pourrait être une alternative moins toxique. Le cyclosphophamide intraveineux est moins efficace que le chlorambucil pour le cyclophosphamide oral et ne doit donc pas être essayé dans le but de diminuer la toxicité.
Il n’y a plus de justification scientifique pour l’utilisation des glucocorticoïdes seuls ou en association avec l’azathioprine chez les patients avec une GEM et un syndrome néphrotique et a fortiori en l’absence de protéinurie néphrotique. Le traitement individualisé peut être proposé selon le schéma suivant :
La cyclosporine doit être réservée aux formes de GEM avec syndrome néphrotique persistant après échec du ou des traitements alkylants (indication essentiellement anti-protéinurique). Le risque de néphrotoxicité aiguë et chronique ne devrait pas inciter à utiliser ce produit en cas dinsuffisance rénale progressive et/ou de fibrose interstitielle connue.
Post-scriptum :
LECTURES RECOMMANDÉES
|
|||||||||||
|
|
| Navigation sur le site : Retour au Sommaire | Plan du site | Haut de page | Mode texte Nouveautés | Abonnement | Statistiques | Syndication | Rédaction Courrier électronique : (remplacer (a) et (.) avant envoi) |
|
Ce site utilise PHP, mySQL, et SPIP sous license GNU/GPL. |
|








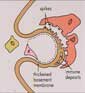
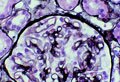
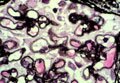
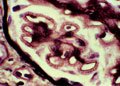

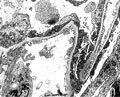
 Membranous glomerulonephritis. Wasserstein AG, JASN 1997 ; 3 :664
Membranous glomerulonephritis. Wasserstein AG, JASN 1997 ; 3 :664