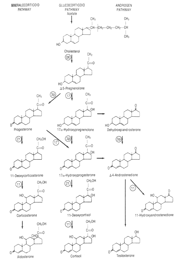
L'alcalose métabolique est observée dans les situations cliniques qui favorisent à la fois la génération et la maintenance de l'alcalose métabolique. Ces situations cliniques peuvent être divisées en trois grandes catégories :
En cas d'insuffisance rénale significative, la clairance du bicarbonate est diminuée et une alcalose métabolique sévère peut survenir après l'administration de bicarbonate exogène. Dans ce cas, il existe souvent la conjonction de plusieurs facteurs comme par exemple l'administration d'acétate ou de carbonate de calcium, voire une supplémentation en bicarbonate de sodium et une contraction volémique par les diurétiques.
L'insuffisance rénale joue aussi un rôle important dans la physiopathologie du syndrome des buveurs de lait et d'alcalins au cours duquel l'augmentation de la charge alcaline liée à l'ingestion de carbonate de calcium et l'hypercalcémie induite par l'insuffisance rénale augmentent toutes deux l'accumulation de bicarbonate et diminue l'excrétion rénale de bicarbonate.
L'insuffisance rénale joue également un rôle important dans la survenue de lalcalose métabolique par association dantacides et de résines échangeuses dion. L'administration d'antacides non réabsorbables n'aboutit habituellement pas à une alcalose métabolique. En effet, bien que le composant carbonate ou hydroxyl de l'antacide tamponne le proton gastrique, ceci est équilibré par la combinaison du cation correspondant de l'antacide (magnésium, aluminium ou calcium) avec le bicarbonate d'origine pancréatique. Cependant chez les patients en insuffisance rénale, traités à la fois par antacides et une résine échangeuse d'ions telle que le polystyrène-sulfonate (Kayexalate®), une partie des cations se lie à la résine laissant davantage de bicarbonate sous forme soluble réabsorbable dans la lumière intestinale. Dans ce cas, l'insuffisance rénale joue un rôle important en perpétuant l'alcalose et en prévenant l'excrétion de l'excès de bicarbonate.
L'administration de quantités aussi importantes que 1000 mmol de bicarbonate de sodium chaque jour n'induit pas d'alcalose métabolique chez les sujets normaux en raison d'une élimination urinaire rapide. Une alcalose métabolique peut cependant survenir lorsque de très grandes quantités de bicarbonate ou de n'importe quel anion organique, comme le lactate ou l'acétate, sont données de façon très aiguë ou lorsqu'il existe une diminution de la capacité d'excrétion du bicarbonate. Par exemple, l'alcalose métabolique post-correction ou rebond peut être induite par l'administration de bicarbonate de sodium pour traiter une acidose lactique ou acidose cétosique. Le bicarbonate administré représente un excès d'alcalins dans la mesure où la correction de la maladie sous-jacente régénère le bicarbonate à partir du métabolisme du lactate ou de l'hydroxybutyrate.
Une alcalose métabolique peut être aussi induite par l'administration de fortes doses de bicarbonate de sodium, de larges quantités de citrates (transfusions de plus de 8 unites sanguines anticoagulées avec du citrate), le recours à une anticoagulation à base de citrate plutôt que d'héparine chez des patients en hémodialyse ou encore l'administration de plasma frais congelé citraté, comme liquide de substitution pendant des échanges plasmatiques.
Ces situations sont caractérisées par une contraction du volume artériel efficace, une circonstance habituellement associée à une diminution de l'apport distal de sodium et une stimulation du système rénine-angiotensine par l'hypovolémie. Si en même temps l'apport distal de sodium est augmenté de façon inappropriée, comme par exemple avec un traitement diurétique, au cours du syndrome de Bartter et au cours des déficits en magnésium ou en raison de la présence dans le tube collecteur d'un anion faiblement réabsorbable, alors l'excrétion nette d'acide est stimulée et l'alcalose peut survenir.
L'alcalose métabolique posthypercapnique est une situation au cours de laquelle l'hypercapnie chronique entraîne une alcalose métabolique compensatoire. Pendant cette période d'hypercapnie, la rétention rénale de bicarbonate s'associe à une chlorurèse qui est secondaire à la rétention de bicarbonate et à l'expansion volémique. Chez les patients hypercapniques, il existe donc une augmentation du contenu en bicarbonate de sodium de l'organisme et une diminution du contenu en chlorure de sodium. Lorsque l'hypercapnie est corrigée le rein essaie de corriger l'alcalose en excrétant le bicarbonate. Cependant, si du chlorure de sodium n'est pas fourni simultanément, la bicarbonaturie entraîne une contraction volémique qui limite la bicarbonaturie et aboutit à la maintenance de l'alcalose métabolique. Seul l'apport de chlorure de sodium dans cette situation corrige l'alcalose.
Plusieurs situations entraînent une alcalose métabolique avec contraction volémique d'origine extrarénale. Il s'agit essentiellement des pertes digestives, tels que les vomissements, l'aspiration naso-gastrique, l'adénome villeux, lachlorhydrie congénitale et une contraction volémique sévère. Dans toutes ces situations, l'alcalose aboutit à une fuite rénale de potassium et cette déplétion potassique contribue à la maintenance de l'alcalose métabolique. La contraction volémique constitue bien le facteur principal responsable de la maintenance de l'alcalose. Si l'on corrige le déficit potassique sans corriger la contraction volémique, l'alcalose métabolique persiste alors que la correction de l'hypovolémie sans correction de l'hypokaliémie permet la correction de l'alcalose métabolique.
d) Alcalose métabolique avec expansion volémique, hypertension artérielle et excès de minéralocorticoïdes
Ces situations cliniques sont caractérisées par une augmentation de l'activité minéralocorticoïde dite "primitive", c'est-à-dire persistant malgré une expansion du volume extracellulaire. Aussi longtemps que l'apport alimentaire en sodium et le sodium délivré au tube distal sont suffisants, l'excrétion nette urinaire de potassium et de protons est augmentée, ce qui aboutit à la déplétion potassique, à la génération et au maintien de l'alcalose métabolique.
Sur une base clinique, trois sous-groupes peuvent être distingués selon le niveau de rénine et d'aldostérone circulante.
- Patients avec un hyperaldostéronisme secondaire à une rénine élevée. Ces conditions comportent la sténose de l'artère rénale, l'hypertension artérielle accélérée ou maligne et la tumeur sécrétant de la rénine (réninome).
- L'hypersécrétion d'aldostérone peut être primitive et associée à une suppression de la rénine plasmatique. Il s'agit de toutes les formes d'hyperaldostéronisme primaire lié à un adénome surrénalien (syndrome de Conn, une hyperplasie surrénale bilatérale, un cancer surrénal ou encore l'hyperaldostéronisme sensible à la dexaméthasone (GRA, maladie génétique au cours de laquelle la synthèse d'aldostérone est sous la dépendance du promoteur de l'ACTH.
- Un troisième groupe de patients présentent des signes d'activité excessive des minéralocorticoïdes mais liés à un agent autre que l'aldostérone. Dans ce cas, la mesure de la rénine et de l'aldostérone plasmatique est abaissée. Ces syndromes comprennent les syndromes adrénogénitaux au cours desquels il existe une hypersécrétion de minéralocorticoïdes non aldostérone, comme la désoxycorticostérone et des syndromes de Cushing avec hypersécrétion de cortisol. Dans cette dernière situation, c'est l'importance de la sécrétion de cortisol et l'activité 11-béta-hydroxystéroïde-déshydrogénase qui détermine l'effet final minéralocorticoïde du cortisol.
En plus du syndrome de Cushing, toutes les situations s'accompagnant d'une diminution d'activité de la 11-béta-hydroxystéroïde déshydrogénase sont responsables d'un état simulant un hyperminéralocorticisme (syndrome d'excès apparent en minéralocorticoïdes). La diminution de l'activité 11-béta-HSD peut être soit génétique (enzyme peu ou pas actif ou acquis notamment en présence d'un inhibiteur, comme l'acide glycérrhétinique présent dans le réglisse, le zan, l'antésite, etc...).
- Un autre syndrome clinque simulant un hyperminéralocorticisme primitif mais sans augmentation de la rénine, de l'aldostérone ou de tout autre minéralocorticoïde connu (pseudohyperaldostéronisme) est le syndrome de Liddle, une maladie hénétique transmise suivant un mode autosomique dominant et caractérisée par une hypertension artérielle, une alcalose métabolique hypokaliémique et une insensibilité au traitement par les antiminéralocorticoïdes (spironolactones). Cette maladie est liée à une mutation activatrice d'une sous-unité du canal épithélial sodé dans le tube cortical augmentant la probabilité d'ouverture et la réabsorption de sodium en échange contre la sécrétion de potassium et de protons. L'ensemble de ces manifestations est corrigé par l'administration d'amiloride (Modamide®) à forte dose.
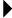 3. Evaluation du patient ayant une alcalose métabolique
3. Evaluation du patient ayant une alcalose métabolique
L'étape initiale consiste en la réalisation des gaz du sang artériel pour vérifier l'existence d'une alcalose métabolique primitive plutôt que de la compensation d'une acidose respiratoire. L'alcalose métabolique est définie par une augmentation du pH sanguin au-delà de 7,42 avec augmentation de la concentration plasmatique de bicarbonate au-dessus de 28 mmol/l.
La deuxième étape consiste à évaluer les facteurs responsables de la maintenance de cette alcalose métabolique :
- insuffisance rénale,
- alcalose maintenue par une contraction volémique,
- alcalose métabolique avec hyperminéralocorticisme et augmentation du débit distal de sodium.
Cette étape nécessite donc l'évaluation du volume circulant efficace sur la base de la pression artérielle, de la fréquence cardiaque et de leurs modifications au cours de l'orthostatisme. L'élévation de l'uricémie et du rapport urée/créatinine plasmatique sont également suggestifs de contraction volémique.
L'interprétation des électrolytes urinaires est généralement très contributive. Les patients ayant une contraction volémique ont généralement une concentration urinaire abaissée de sodium et de chlore. Cependant la bicarbonaturie ou l'excrétion d'autres anions non réabsorbables peut augmenter la natriurèse même en présence d'une contraction volémique. Dans ce cas, la concentration urinaire de chlore est un indice plus spécifique.
Une concentration urinaire de chlore abaissée en-dessous de 25 mmol/l, est fortement suggestive de contraction volémique.
Lorsque la concentration de sodium est dissociée et élevée, il s'agit probablement d'une bicarbonaturie ou de l'excrétion urinaire d'un excès d'anions non réabsorbables. Cette situation peut être facilement distinguée à partir du pH urinaire. Un pH urinaire supérieur à 7 suggère une bicarbonaturie significative. Un pH urinaire inférieur à 6,5 suggère au contraire la présence d'un anion non réabsorbable comme de l'hydroxybutyrate ou un antibiotique. Ce diagnostic différentiel est habituellement facile compte tenu du contexte. S'il existe une bicarbonaturie significative, cela suggère une génération extrarénale de bicarbonate liée à des vomissements, une aspiration naso-gastrique, une perte de chlore, une diarrhée dans un contexte clinique généralement évident.
Une concentration urinaire de chlore élevée chez un patient ayant une contraction volémique suggère le rôle des diurétiques, d'un syndrome de Bartter ou de Gitelman, ou une déplétion en magnésium.
Si les concentrations urinaires de sodium et de chlore sont abaissées, la cause de l'alcalose peut être posthypercapnique, ou liée à des les diurétiques juste après leur arrêt ou des vomissements à distance.
Si le patient a une hypertension artérielle et apparaît volémique ou en expansion volémique, une augmentation primitive des minéralocorticoides est plus vraisemblable.
La détermination de la rénine et de l'adostérone plasmatique représente l'étape suivante. Si la rénine et l'aldostérone sont toutes deux élevées, il est important de s'assurer que la patient n'était pas en contraction volémique au moment de la mesure et ceci peut être éliminé par un test de suppression par un soluté salé. Le diagnostic est plus facile si la rénine plasmatique est effondrée ce qui oriente vers un hyperminéralocorticisme primitif.
Une situation plus délicate est représentée par le patient avec une hypertension et traité par un diurétique thiazidique. Il n'est pas toujours facile de déterminer dans ce cas si l'alcalose hypokaliémique est liée à un hyperminéralocorticisme primitif sous-jacent ou seulement à l'effet du traitement diurétique. La natrémie peut être d'une certaine aide : plutôt élevée à 140-146 mmol/l chez un patient ayant un hyperminéralocorticisme sous-jacent, légèrement abaissée à 136 - 138 chez un malade uniquement sous thiazide.
 4. Conséquences cliniques de l'alcalose métabolique
4. Conséquences cliniques de l'alcalose métabolique
L'alcalose métabolique est généralement perçus à tort comme une condition bénigne. Cependant l'alcalose métabolique contribue significativement à la mortalité. Il a été montré ainsi une relation directe entre l'augmentation du pH sanguin et la mortalité hospitalière chez des patients avec un pH sanguin supérieur à 7,48. La démonstration de cause à effet n'est pas établie et l'alcalose pourrait être seulement un marqueur de mauvais pronostic.
Plusieurs arguments suggèrent cependant un rôle direct de l'alcalose. Tout d'abord, l'alcalose déprime la respiration par un effet à la fois central et périphérique sur les chémorécepteurs. De plus, l'alcalose diminue l'apport d'oxygène au niveau tissulaire par l'effet Bohr, l'alcalose déplace la courbe de dissociation en oxygène de l'hémoglobine en diminuant la capacité de l'hémoglobine à relarguer l'oxygène dans les tissus périphériques.
De plus, l'alcalose est un vasoconstricteur puissant, diminuant la perfusion dans de nombreux organes tels que le cerveau, le rein, le coeur et la circulation périphérique. Cette diminution de la perfusion tissulaire peut devenir critique notamment chez les patients ayant une contraction volémique associée.
La vasoconstriction et l'hypoxémie induite par l'alcalose peuvent aboutir à une hypoxémie tissulaire critique dans certaines conditions. L'alcalose précipite les douleurs thoraciques, l'élévation du segment ST et les spasmes sur l'angiographie coronaire chez des patients avec un angor de Prinzmetal. L'alcalose induite une insuffisance coronaire en présence ou en l'absence de maladie sténosante coronaire. L'alcalose favorise la survenue d'arythmies cardiaques qui sont insensibles aux antiarythmiques usuels et ne répondent qu'à la corection de l'alcalose. L'alcalose constitue donc un facteur pronostic important, notamment chez les patients en situation de réanimation.
 5. Traitement de l'alcalose métabolique
5. Traitement de l'alcalose métabolique
Le traitement de l'alcalose métabolique fait appel essentiellement à la correction du facteur responsable de la maintenance de cette alcalose. Il est de plus souvent utile de corriger le facteur qui a généré cette alcalose.
En cas d'alcalose métabolique maintenue par la contraction volémique, l'administration de chlorure de sodium est efficace. Il n'est généralement pas nécessaire de donner du potassium pour la correction de l'alcalose mais il est souhaitable de corriger une carence en magnésium, une carence sévère en potassium (par du KCl), de supprimer lorsque c'est possible la source de l'excès en minéralocorticoodes, d'arrêter un traitement diurétique ou une aspiration naso-gastrique. Lorsque l'aspiration naso-gastrique reste indispensable, le recours à un bloqueur des récepteurs H2 (type cimetidine) ou un IPP (type omeprazole) peut diminuer la tendance à générer une alcalose métabolique.
Une alcalémie sévère définie par un pH sanguin > 7,60 et une bicarbonatémie > 45 mmol/l en présence dune réponse ventilatoire adaptée nécessite une intervention immédiate ayant pour but une correction au moins partielle de lalcalémie, les cibles étant une bicarbonatémie de 35-40 mmol/l correspondant à un pH sanguin de 7,50-7,55. Les alcalémies métaboliques les plus sévères sont généralement les formes associées à une contraction du volume extracellulaire par un déficit en chlore (pertes dacide gastrique et traitements diurétiques). La correction de l'alcalose est particulièrement importante :
- chez les patients ayant une maladie pulmonaire chronique chez lesquels l'intubation est imminente ou l'extubation difficile et chez lesquels l'alcalose métabolique nécessite d'être corrigée pour améliorer l'état ventilatoire,
- chez les patients ayant une ischémie myocardique avec infarctus évolutif ou ayant une douleur récurente postinfarctus ou un angor instable,
- chez les patients ayant des troubles neurologiques et des fonctions supérieures chez lesquels l'hypoperfusion cérébrale pourrait être un facteur contributif.
Lorsque la vitesse de correction de lalcalémie doit être accélérée, lexcès dalcalin peut être titré par ladministration IV dacide chlorhydrique. La perfusion d'acide chlorhydrique par voie intraveineuse, habituellement dans une solution salée isotonique 0,1 ou 0,2 N (cest à dire 100 à 200 mmol dhydrogène par litre) sur 8 à 24 heures représente une méthode sûre et très efficace de correction de lalcalémie métabolique. La solution doit être injectée par voie veineuse centrale car l'HCl est très corrosif mais éventuellement aussi dans une veine périphérique si l'HCl est tamponné par une solution d'amino-acides dans une nutrition parentérale totale. La quantité d'HCl nécessaire en mmol peut être estimée à partir de l'espace de distribution du bicarbonate que multiplie l'excès de bicarbonate (HCl en mmol = 0,5 x poids du corps x (&Mac198; concentration plasmatique de bicarbonate observée souhaitée).
Les précurseurs de lacide chlorhydrique comme le chlorure d'ammonium ou lhydrochloride d'arginine sont utilisés beaucoup moins souvent en raison des risques substantiels : risque d'hyperkaliémie extrêmement sévère avec lhydrochloride d'arginine en particulier sil existe une insuffisance rénale ou hépatique ; risque dhyperammoniémie et dencéphalopathie hépatique chez les patients avec une insuffisance hépatique.
Chez certains patients, avec une insuffisance cardiaque ou rénale ne permettant pas l'administration de chlorure de sodium ou lhydrochloride d'arginine le traitement est particulièrement délicat.
- Chez les patients en bilan sodé positif et dont l'alcalose de contraction se majore sous traitement diurétique par diurétique de l'anse, on peut recourir à un inhibiteur de l'anhydrase carbonique (acétazolamide, Diamox®). L'effet bicarbonaturiant est directement lié à la concentration plasmatique de bicarbonate si bien que la concentration de bicarbonate retourne rarement à la normale avec ce traitement. Le risque est essentiellement l'aggravation de l'hypercapnie, en particulier chez des patients ayant une acidose respiratoire chronique. L'anhydrase carbonique est normalement présente dans les érythrocytes et contribue au transfert du CO2 depuis les tissus périphériques vers les hématies et des hématies vers les alvéoles pulmonaires. L'inhibition de l'anhydrase carbonique peut donc limiter la captation de CO2 par les hématies ainsi que le relarguage du CO2 au niveau du poumon. Cette situation expose à une augmentation de la PCO2 dans les tissus périphériques. La dose dacétazolamide est de 250 à 375 mg une à deux fois par jour. Les patients doivent être relativement normokaliémiques avant l'administration d'acétazolamide. L'augmentation de la PCO2 est habituellement transitoire de l'ordre de 3 à 7 mmHg.
- En cas de surcharge hydrosodée associée à une alcalose de contraction réfractaire il est souvent nécessaire de recourir à des techniques dépuration extrea-rénales pour corriger à la fois lalcalémie et la surcharge hydro-sodée.
Chez les patients avec une alcalose métabolique et expansion volémique liée à un excès primitif de minéralocorticoides, il est nécessaire d'intervenir sur la cause de cette hyperactivité minéralocorticoide. Quand cela n'est pas possible un traitement symptomatique peut être utilisé à base soit de spironolactone (Aldactone®) qui bloque compétitivement le récepteur aux minéralocorticoides, soit par l'administration de diurétiques dits épargneurs du potassium (amiloride, Modamide®) qui bloquent la conductance sodique dans le tube collecteur cortical. Ces médicaments permettent de corriger à la fois l'alcalose métabolique et l'hypokaliémie.
Au cours du syndrome de Liddle, la spironolactone est inefficace mais l'ensemble des anomalies peut être corrigé spécifiquement par un bloqueur de la conductance sodium comme l'amiloride, souvent à fortes doses.